

Случай 1. Ишемическая болезнь сердца и коронарное шунтирование. Интраоперационное ведение.
|
|
|
|
|
|
| |
|
| |
|
|
|
|
 |
|
3. Интраоперационное ведение A. До начала искусственного кровообращения.
- ЭКГ: одновременный мониторинг отведений II и V5, анализ сегмента ST во многих отведениях, если позволяет монитор
Тест Алена используется для оценки коллатерального кровообращения в кисти. Лучевая и локтевая артерии пережимаются проводящим тест. Затем пациента просят сжать кулак, чтобы обескровить кисть. Кулак необходимо держать выше уровня сердца. Если пациент находится в состоянии анестезии, кровь может быть дренирована ассистентом, сжимающим кисть. После этого кулак медленно разжимается и кисть опускается до уровня сердца. Снимается давление только с локтевой артерии и засекается время, за которое кисть наполнится кровью. Нормальный результат: менее 7 секунд Кроме этого, может быть использован модифицированный тест Аллена, если в наличии есть Доплеровский датчик или пульсоксиметр. Результаты проведения теста выявляют нарушение коллатерального кровообращения в 3% случаев. Однако, Slogoff, Keats и Arlund изучили осложнения, связанные с катетеризацией лучевой артерии у 1699 кардиохирургических пациентов, и пришли к выводу, что, в отсутствие патологии периферических артерий, тест Алена не является прогностическим для определения риска развития ишемии кисти во время или после катетеризации лучевой артерии и что катетеризация является процедурой низкого риска, но представляет большие преимущества для мониторинга и заслуживает широкого клинического применения. Однако, в наше время, когда то и дело пациенты подают иски на врачей, возможно, разумным подходом всё же будет использование этого теста, хотя бы для формальной документирования. Cederholm I. Sorensen J. Carlsson C. Thrombosis following percutaneous radial artery cannulation. Acta Anaesthesiol Scand 1986:30:227. Kaplan J, Cardiac anesthesia4th ed. Philadelphia: WB Saunders, 1999:324. Miller RD, Anesthesia5th ed. New York: Churchill Livingstone, 2000:1125. Slogoff S. Keats AS. Arlund C. On the safety of radial artery cannulation. Anesthesiology 1983:59:42.
Во многих медицинских центрах измерение температуры в двух или более точках является общепринятой практикой. Во время охлаждения и согревания ткани организма обладают разной температурой. Температура ядра может измеряться в пищеводе, носоглотке или на барабанной перепонке, периферическая температура измеряется в прямой кишке. Во время охлаждения и согревания крови в теплообменнике оксигенатора температура в пищеводе изменяется быстро, а в прямой кишке – медленно. Во время охлаждения и согревания кожных покровов мы имеем противоположную ситуацию.Для того, чтобы оценить среднюю температуру и добиться равномерного её распределения, необходимо знать как ректальную, так и пищеводную температуры. Gravlee GP. Davis RF. Karusz M, et al.Cardiopulmonary bypass, principles and practice Philadelphia: Lippincott Williams & Wilkins, 2000:567–568. Kaplan J, Cardiac anesthesia4th ed. Philadelphia: WB Saunders, 1999:1069.
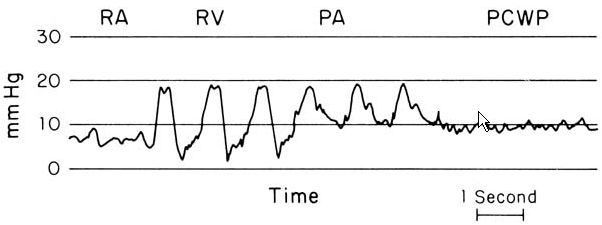
Кривые давления при постановке катетера Сван-Ганса имеют три главных отличия (см. рисунок).
Кривые давления в правом предсердии (RA), правом желудочке (RV), лёгочной артерии (PA) и давление заклинивания лёгочных капилляров (PCWP). Диастолическое давление в лёгочной артерии выше, чем в правом желудочке Давление в ЛА: 20-25/5-10 мм рт. ст. Внешний вид кривой Кривая давления в ЛА имеет характерную выемку, обусловленную закрытием пульмонального клапана Наполнение желудочков В позднюю диастолу давление в ЛА снижается, в то время как давление в правом желудочке растёт из-за наполнения желудочков
Нормальное: 4 – 12 мм рт. ст Braunwald E, Zipes DP, Libby P, Heart disease, a textbook of cardiovascular medicine6th ed. Philadelphia: WB Saunders, 2001:372–373.
Необходимость мониторинга давления в ЛА зависит от функции ЛЖ. Пациенты могут быть подразделены на 2 категории на основании функции левого желудочка. Для пациентов с хорошей функцией ЛЖ (ФВ > 0.5, и хорошая сократимость), ЦВД хорошо коррелирует с ДЗЛК; таким образом, мониторинг давления в лёгочной артерии может быть ненужным для таких пациентов. У пациентов со сниженной функцией ЛЖ (ФВ < 0.4, или желудочковая диссинергия), ЦВД не коррелирует с ДЗЛК; таким образом, показан мониторинг давления в ЛА. Прочие показания для мониторинга давления в ЛА составляют наличие лёгочной гипертензии, сочетанный коронарный стеноз и клапанная патология, и сложные поражения сердца. Однако, на основании обзорного исследования критически больных пациентов, после корректировки, связанной с выбором той или иной терапии, мониторинг давления в ЛА был связан с большей смертностью и повышенным использованием ресурсов. Причина этого отсутствия преимуществ не ясна. Результат этого исследования должен быть подтверждён дальнейшими испытаниями. American Society of Anesthesiologists. Practice guidelines for pulmonary artery catheterization. Anesthesiology 1993:78:380–394. Connors AF. Speroff T. Dawson NV, et al.The effectiveness of right heart catheterization in initial care of critically ill patients. JAMA 1996:276:889–897. Mangano DT. Monitoring pulmonary arterial pressure in coronary-artery disease. Anesthesiology 1980:53:364–369.
Связанные с венепункцией (такие же как и для установки катетера для мониторинга давления в лёгочной артерии) Основные осложнения: - Инфекционные: сепсис Подключичный доступ: - Пневмоторакс Доступ через внутреннюю яремную вену: - Пневмоторакс При доступе через v. basilica или v. cephalica осложнения возникают реже, впрочем как и частота успешной катетеризации. Связанные с катетером Сван-Ганса Аритмии (1.5 – 11%), полная блокада сердца, тромбоэмболии, инфаркт лёгкого из-за постоянного заклинивания, массивное кровотечение вследствие перфорации ЛА, или правого предсердия, невозможность достигнуть положения заклинивания, кровохарканье, сворачивание катетера и образование узлов в сердце, разрыв баллона, эндокардиальные тромбы и повреждение трёхстворчатого клапана. Barash PG, Cullen BF, Stoelting RK, Clinical anesthesia4th ed. Philadelphia: Lippincott Williams & Wilkins, 2001:818. Miller RD, Anesthesia5th ed. New York: Churchill Livingstone, 2000:1160–1164.
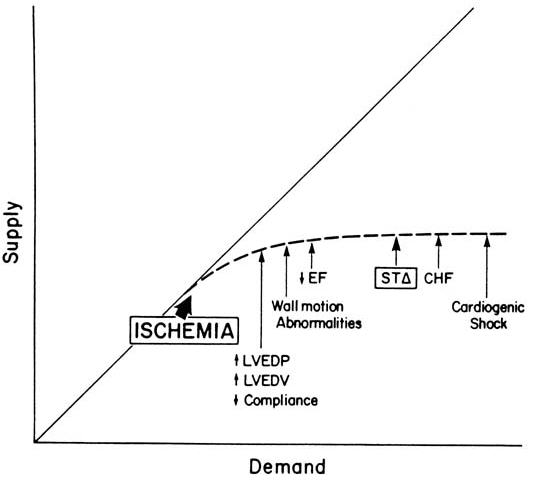
В течение четырёх десятилетий после классического наблюдения, сделанного Tennant и Widgers, об эффектах коронарной окклюзии на сокращение миокарда, существовало мнение, что транзиторная тяжёлая ишемия вызывала либо необратимое повреждение миокарда, то есть, инфаркт, либо после неё происходило быстрое восстановление. Однако, в 1970-х стало ясно, что после короткого эпизода тяжёлой ишемии, наступала длительная дисфункция миокарда с постепенным возвращением сократительности, состояние, именуемое станнирование миокарда. С другой стороны, тяжёлая хроническая ишемия может привести к снижению сократимости, таким как хронические нарушения движения стенок желудочка (гибернация). Острая ишемия миокарда затрагивает систолическую и диастолическую функции. Систолическая дисфункция обычно проявляется перед изменением диастолической. Непосредственное воздействие на растяжимость желудочка связано с этиологией ишемического события. Напротив, повышенная потребность миокарда в кислороде связана с немедленной потерей растяжимости (желудочек становится жёстким). Таким образом, желудочек нуждается в более высоком давлении наполнения (конечно-диастолическом давлении (КДД)) для поддержания данного ударного объёма. Результатом этого могут быть нарушения кинетики стенок, аритмии, блокады проведения. Снижение коронарного кровотока на 80% вызывает акинезию, а 95% снижение вызывает дискинезию. Если ишемия становится тяжёлой, нарастание КДД приведёт к отёку лёгких (см. рисунок).
Гемодинамические последствия ишемии миокарда. Ишемия наступает, когда потребность превышает обеспечение. (LVEDP, конечно-диастолическое давление в левом желудочке; LVEDV, конечно-диастолический объём ЛЖ; EF, фракция выброса; ST, изменения сегмента ST; CHF, застойная сердечная недостаточность) Хотя для диагностики ишемии имеется много чувствительных методик, таких как магнито-резонансная спектроскопия, определение радиоактивного лактата, или прямое измерение КДД, они не подходят для практического применения. Наиболее популярный метод диагностики ишемии – наличие горизонтальной или косонисходящей депрессии сегмента ST на ЭКГ. Критерием является горизотальная или косонисходящая депрессия ST как минимум на 0.1 mV через 0.06 секунд после точки J, либо косовосходящая депрессия минимум на 0.2 mV через 0.08 секунд через точки J, либо подъём сегмента ST минимум, на 0.15 mV (1 mV = 10 мм). Прочие ЭКГ-признаки ишемии включают инвертированные Т-волны с дебютом аритмии или нарушения проведения. Нарушения кинетики стенок желудочка (НКСЖ), определяемые с помощью двухмерной (2D) эхокардиографии, являются самым ранним и самым чувствительным признаком ишемии миокарда. Снижение коронарного кровотока на 25% вызывает НКСЖ без изменений на ЭКГ, а 50% снижение вызывает ЭКГ-признаки ишемии. У пациентов с ИБС, во время физической нагрузки, НКСЖ наступали через 30 секунд, а изменения на ЭКГ – через 90. Smith и коллеги обнаружили, что НКСЖ являются в 4 раза более чувствительным индикатором ишемии, нежели ЭКГ-признаки. Более того, изменения сегмента ST не могут быть проанализированы, если у пациента имеются нарушения проведения, такие как блокада ветви пучка Гиса, или искусственный желудочковый ритм. Они также обнаружили, что у пациентов, имеющих хронические НКСЖ, чаще возникает инфаркт миокарда, чем у пациентов с транзиторными изменениями. Ни у одного пациента с впервые возникшими НКСЖ не было инфаркта миокарда. Мы надеемся, что в будущем появятся более компактные и дешевые аппараты для проведения эхокардиографии. Хотя ТПЭхо является самым чувствительным индикатором ишемии миокарда, недавнее исследование, проведённое Eisenberg и коллегами заключает, что рутинный мониторинг ишемии миокарда с ТПЭхо, или 12-канальной ЭКГ во время несердечных операций даёт немного преимуществ по сравнению с анализом клинических показателей перед операцией и двухканальным ЭКГ-мониторингом. ДЗЛК было предложено как ранний и чувствительный индикатор ишемии, для использования при недиагностической ЭКГ. Хотя острое нарастание ДЗЛК, либо возникновение V-волн могут говорить об ишемии, отсутствие изменений ДЗЛК не гарантирует её отсутствия. Haggmark и коллеги сообщили, что чувствительность, специфичность и прогностическая значимость (положительная и отрицательная) измерения ДЗЛК при ишемии варьировала от 40% до 60%. У пациентов, идущих на коронарное шунтирование, Liberman и коллеги также определили низкую положительную прогностическую значимость (24%), но более высокую отрицательную прогностическую значимость (85%); однако, измерение ДЗЛК не имеет преимуществ над измерением ЦВД, кроме их измерения у пациентов с умеренной – тяжёлой дисфункцией желудочков. Barash PG. Monitoring myocardial oxygen balance: physiologic basis and clinical application. ASA Refresher Courses in Anesthesiology Park Ridge, IL: American Society of Anesthesiologists, 1985:13:21–32. Barash PG. Monitoring myocardial ischemia: a sequential clinical approach. ASA Annual Meeting Refresher Course Lectures Park Ridge, IL: American Society of Anesthesiologists, 2002:233. Barash PG. Sequential monitoring of myocardial ischemia in the perioperative period. ASA Annual Meeting Refresher Course Lectures Park Ridge, IL: American Society of Anesthesiologists, 2002:233. Eisenberg MJ. London MJ. Leung JM, et al.Monitoring for myocardial ischemia during noncardiac surgery: a technology assessment of transesophageal echocardiography and 12-lead electrocardiography. JAMA 1992:268:210–216. Haggmark S. Hohner P. Ostman M, et al.Comparison of hemodynamic, electrocardiographic, mechanical, and metabolic indicators of intraoperative myocardial ischemia in vascular surgical patients with coronary artery disease. Anesthesiology 1989:70:19–25. Kaplan JA. Wells PH. Early diagnosis of myocardial ischemia using the pulmonary artery catheter. Anesth Analg 1981:60:789–793. Leung J. O'Kelly B. Browner W, et al.Are regional wall motion abnormalities detected by transesophageal echocardiography triggered by acute changes in supply and demand? [Abstract]. Anesthesiology 1988:69:A801. Lieberman RW. Orkin FK. Jobes DR, et al.Hemodynamic predictors of myocardial ischemia during halothane anesthesia for coronary artery revascularization. Anesthesiology 1983:59:36–41. Mangano DT. Perioperative cardiac morbidity. Anesthesiology 1990:72:153–184. Roizen MF. Beaupre PN. Alpert RA, et al.Monitoring with two-dimensional transesophageal echocardiography: comparison of myocardial function in patients undergoing supraceliac, suprarenal-infraceliac, or infrarenal aortic occlusion. J Vasc Surg 1984:1:300–305. Smith JS. Cahalan MK. Benefiel DJ, et al.Intraoperative detection of myocardial ischemia in high-risk patients: electrocardiography versus two-dimensional transesophageal echocardiography. Circulation 1985:72:1015–1021.
Мониторинг ЭКГ в нескольких отведениях является лучшим клинически доступным методом диагностики интраоперационной ишемии. На основании данных тредмилл-тестов, одновременный мониторинг отведений II и V5, при котором могут быть зафиксированы 96% эпизодов ишемии, является оптимальным. Однако, London и колл. недавно обнаружили, что мониторинг II и V5 у пациентов с известной или подозреваемой ИБС, подвергающихся внесердечным вмешательствам, обладал только 80% чувствительностью, в то время как комбинация отведений V4 и V5 увеличивала чувствительность до 90%. При комбинации отведений II, V4 и V5 чувствительность повышалась до 96%. Если на мониторе может отображаться только одно отведение, следует использовать V5, поскольку оно обладает наибольшей чувствительностью, 75% интраоперационно и 89% во время тредмилла. Blackburn H. Katigbak R. What ECG leads to take after exercise. Am Heart J 1964:l67:184–185. London MJ. Hollenberg M. Wong MG, et al.Intraoperative myocardial ischemia: Localization by continuous 12-lead electrocardiography. Anesthesiology 1988:69:232–241.
ТПЭхо является широко используемой методикой для визуализации анатомии и работы сердца. Эхокардиография основана на базовых принципах существования ультразвука. Ультразвуком называются колебания воздуха с частотой, превышающей порог слышимости человеческого уха – 20000 Hz. Ультразвуковые волны (1 – 7 МГц) создаются путём воздействия на определённый пьезоэлектрический кристалл переменным электрическим током с частотой 500 – 1500 импульсов в секунду. При этом испускаются кратковременные импульсы высокочастотного звука малой интенсивности, они направляются через тело человека для определения границ с различным акустическим сопротивлением. Ультразвуковая волна частично отражается от границы тканей с разным акустическим сопротивлением, свойство, которое в основном определяется небольшим различием в плотности между тканями. Это явление называется пульс-отражённый ультразвук. Прохождение такого ультразвукового сигнала через сердце с определением отражённых эх, позволяет определить расположение и движение акустических поверхностей в сердце, что в обиходе и называется эхокардиографией. Отличие между М-режимом и двухмерной визуализацией заключается в том, что ультразвуковой режим в М-режиме направлен в одном направлении и поэтому отражает только одно измерение изучаемой структуры в виде изображения, которое не напоминает строение сердца. При работе кристалла в двухмерном режиме пучок звука описывает дугу, в результате чего возникают акустические срезы анатомических структур, которые можно узнать. Доплер-эхокардиография представляет собой альтернативный метод визуализации кровотока путём применения анализа Доплеровского сдвига к эхам, отражаемым от движущихся эритроцитов. Принцип Доплера говорит о том, что частота ультразвука, отражаемая от движущегося объекта, отличается от частоты испускаемого кристаллом ультразвука. Цветная допплер-эхокардиография позволяет создавать изображения потоков крови в камерах сердца и самих структур сердца в реальном времени в двух измерениях: цветные изображения потоков на фоне монохромных акустических срезов эхокардиограмм. Цветной Доплер намного упрощает оценку функции клапанов и внутрисердечных шунтов. Клиническое приложение интраоперационной эхокардиографии изложено в следующих разделах. Мониторинг наполнения и функции левого желудочка Когда проводится мониторинг поперечного сечения левого желудочка по короткой оси на уровне средней сосочковой мышцы, ТПЭхо позволяет анестезиологу количественно оценивать преднагрузку и функцию левого желудочка в реальном времени, что даёт возможность регулировать введение растворов и инотропов. Ишемическая болезнь сердца Нарушения движения сегментов стенки желудочка, такие как гипокинезия, акинезия и дискинезия, являются самыми ранними признаками ишемии миокарда. Определение утолщения стенки во время систолы, еще один знак ишемии миокарда, к сожалению, невоспроизводимо, из-за трудности в точной визуализации края эпикарда в двухмерном режиме. Поражение клапанов сердца: воздушная эмболия Во время операций на открытом сердце, с помощью ТПЭхо можно регистрировать воздушные эмболы в левом предсердии, левом желудочке и аорте. Таким образом, ТПЭхо может помочь хирургу добиться более качественной деаэрации левых камер перед тем, как сердце начнёт выбрасывать кровь с воздухом в системную циркуляцию. Недостаточность клапанов Недостаточность клапанов может быть обнаружена во время операции с помощью цветной Доплер-эхокардиографии непосредственно после консервативного восстановления клапана, аннулопластики, коммиссуротомии или пртоезирования клапана. Врождённые пороки сердца ТПЭхокардиография представляет собой более агрессивный подход к сложным реконструкциям на сердце, поскольку у хирурга появляется возможность визуализировать сердце и оценить адекватность хирургического восстановления немедленно после операции. Грудная аорта ТПЭхо позволяет проводить точную диагностику аневризм грудной аорты, их расслоения, разрыва, а также атероматоза. В Корнельском центре в Нью-Йорке ТПЭхо рутинно применяется для скрининга тяжёлого атероматоза дуги и нисходящей аорты у всех пациентов. Эпиаортальная эхокардиография проводится, если в дуге и нисходящей аорте определяется тяжёлый атероматоз. Тяжёлый атероматоз грудной аорты является независимым прогностическим признаком для неврологического статуса после операции. Атеромы классифицируются следующим образом: Класс I, нормальное-умеренное утолщение интимы; класс II, тяжёлое утолщение интимы; класс III, атерома, выступающая менее, чем на 5 мм в просвет; класс IV, атерома, выступающая в просвет более, чем на 5 мм; класс V, атерома с мобильным компонентом. Опухоли сердца С помощью ТПЭхо можно легко диагностировать миксому предсердия. Предоперационное и послеоперационное ТПЭхо с контрастом может позволить оценить наличие и тяжесть митральной регургитации вследствие нарушения функции клапана пролабирующей миксомой. Прочие поражения сердца Гипертрофическая обструктивная кардиомиопатия (идиопатический гипертрофический субаортальный стеноз) может быть идентифицирован при развитии систолического движения вперёд митрального клапана. Тампонада сердца при выпоте в полость перикарда или гемоперикарде может быть определена во время предоперационного обследования Нейрохирургия ТПЭхо является самым чувствительным индикатором для определения венозной эмболии во время нейрохирургических операций в сидячем положении. Можно также диагностировать открытое овальное окно и парадоксальную воздушную эмболию. Braunwald E, Zipes DP, Libby P, Heart disease, a textbook of cardiovascular medicine6th ed. Philadelphia: WB Saunders, 2001:160–221. Cahalan MK. Transesophageal echocardiography: should I be using it?. ASA Refresher Courses in Anesthesiology 1990:18:69–84. Clements FM. de Bruijn NP. Perioperative evaluation of regional wall motion by transesophageal two-dimensional echocardiography. Anesth Analg 1987:66:249–261. Feigenbaum H. Echocardiography. 5th ed. Philadelphia: Lea & Febiger, 1994:1–32, 514. Kaplan J, Cardiac anesthesia4th ed. Philadelphia: WB Saunders, 1999:114–122.
Перед установкой артериальной магистрали вводится мидазолам, 1-2 мг. Для профилактики гипотензии, гипертензии и тахикардии необходима гладкая индукция. Для этого можно использовать различные методики. У пациентов с хорошей функцией левого желудочка, индукция проводится фентанилом, 5-10 мкг/кг и мидазоламом, титруя по эффекту. После того, как пациент заснёт, вводится мышечный релаксант и производится интубация. У пациентов с плохой функцией ЛЖ следует избегать применения ингаляционных анестетиков, таких как энфлюран, изофлюран и галотан. В качестве подходящего гипнотика для индукции у них можно рассматривать этомидат. Martin DE. Rosenberg H. Aukburg SJ, et al.Low-dose fentanyl blunts circulatory responses to tracheal intubation. Anesth Analg 1982:61:680–684.
Популярным выбором будет комбинация фентанила с изофлюраном. Мидазолам на этапе ИК, если в АИК не встроен испаритель.
Одним из факторов для выбора является желательность ранней экстубации. Если она желательна, следует избегать введения больших дозировок опиоидов, гипнотиков и мышечных релаксантов. Результаты трёх широких исследований, проведённых на пациентах, подвергающихся операциям КШ показали, что выбор анестетика не влиял на частоту периоперационных осложнений и смертность. Merin RG. Verdoaw PD. de Jong JW, et al.Myocardial functional and metabolic responses to ischemia in swine during halothane and fentanyl anesthesia. Anesthesiology 1982:56:84–92. Slogoff S. Keats AS. Randomized trial of primary anesthetic agents on outcome of coronary artery bypass surgery. Anesthesiology 1989:70:179–188. Slogoff S. Keats AS. Dear WE, et al.Steal-prone coronary anatomy and myocardial ischemia associated with four primary anesthetic agents in humans. Anesth Analg 1991:72:22–27. Tuman KJ. McCarthy RJ. Spiess BD, et al.Does choice of anesthetic agent significantly affect outcome after coronary artery surgery?. Anesthesiology 1989:70:189–198.
В общем, галотан, энфлюран, изофлюран, десфлюран и севофлюран вызывают дозозависимую депрессию желудочковой функции и сосудистого тонуса. Галотан сенситизирует сердце к катехоламинам, намного более, чем остальные перечисленные выше препараты. Изофлюран и десфлюран подавляют сердечный выброс в меньшей степени, чем галотан или энфлюран из-за своего большего вазодилятирующего эффекта. Изменения ЧСС минимальны при использовании галотана и более всего заметны при применении десфлюрана. Изофлюран может вызывать тахикардию; механизм неясен. Результаты большинства исследований предполагают, что галотан, энфлюран и изофлюран снижают сопротивление коронарных сосудов. Изофлюран является самым сисльным коронародилятатором. Все препараты дозозависимо снижают АД. Механизм включает вазодилятацию, уменьшение сердечного выброса вследствие депрессии миокарда, а также снижение симпатического тонуса. При использовании галотана главной причиной является снижение сердечно выброса. Галотан также повышает венозное сопротивление и у пациентов с высоким симпатическим тонусом, как, например, при сердечной недостаточности, галотан уменьшает системное сосудистое сопротивление. Энфлюран вызывает вазодилятацию и снижение сократимости миокарда. При использовании изофлюрана и десфлюрана главной причиной гипотензии является низкое сосудистое сопротивление. Доказательством относительно большей депрессии миокарда при применении галотана и энфлюрана является большее увеличение давления в правом предсердии, чем при использовании изофлюрана. Опиоиды, такие как морфин и фентанил, при использовании в клинической дозировке обладают минимальными сердечно-сосудистыми эффектами. Оба могут вызывать брадикардию. Ни один не сенситизрует сердце к катехоламинам или подавляет функцию миокарда. Сердечно-сосудистые эффекты морфина зависят от дозы. Setha и колл. обнаружили, что морфина сульфат, 0.25 мг/кг внутривенно, не вызывал глобальной ишемии миокарда у пациентов с ИБС. Высокие дозы морфина, 1 мг/кг вызывали значительное снижение АД и периферического сосудистого сопротивления, что сопровождалось возрастанием уровня гистамина в плазме на 750%. С другой стороны, высокие дозы фентанила, 50 мкг/кг, не вызывают каких-либо значительных изменений АД, сосудистого сопротивления и уровня гистамина в плазме. Barash PG, Cullen BF, Stoelting RK, Clinical anesthesia4th ed. Philadelphia: Lippincott Williams & Wilkins, 2001:387–396. Kaplan JA, Cardiac anesthesia4th ed. Philadelphia: WB Saunders, 1999:702–705. Malan TP. DiNardo JA. Isner RJ, et al.Cardiovascular effects of sevoflurane compared with those of isoflurane in volunteers. Anesthesiology 1995:83:918–928. Sethna DH. Moffitt EA. Gray RJ, et al.Cardiovascular effects of morphine in patients with coronary artery disease. Anesth Analg 1982:61:109–114.
Продолжение следует ... |
|---|
| copyright (c) 2006, Cardiac Surgical ICU at Leningrad Region Hospital, all rights reserved. |